Pivalaldehyd
Heutzutage ist Pivalaldehyd zu einem wiederkehrenden Thema in Diskussionen und Debatten weltweit geworden. Die Bedeutung von Pivalaldehyd spiegelt sich in seinen Auswirkungen auf Gesellschaft, Wirtschaft und Politik wider und macht es zu einem interessanten Punkt für Forscher, Führungskräfte und Bürger gleichermaßen. Im Laufe der Geschichte hat Pivalaldehyd zahlreiche Veränderungen und Transformationen verursacht und sowohl Begeisterung als auch Kontroversen hervorgerufen. In diesem Artikel werden wir verschiedene Aspekte im Zusammenhang mit Pivalaldehyd ansprechen und seine Auswirkungen in verschiedenen Kontexten analysieren. Von seinem Einfluss auf das tägliche Leben bis hin zu seiner Rolle auf der globalen Bühne nimmt Pivalaldehyd weiterhin einen wichtigen Platz auf der Tagesordnung aller ein.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
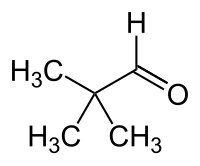
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Pivalaldehyd | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H10O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 86,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,793 g·cm−3 (25 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
74 °C (973 hPa)[1] | ||||||||||||||||||
| Dampfdruck |
14,8 kPa (20 °C)[2] | ||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[2] | ||||||||||||||||||
| Brechungsindex |
1,378 (20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Pivalaldehyd (auch Pivalinaldehyd) ist eine chemische Verbindung aus der Gruppe der Aldehyde. Mit seinen Isomeren Valeraldehyd (n-Pentanal), Isovaleraldehyd und 2-Methylbutyraldehyd bildet er die Stoffgruppe der Pentanale.
Verwendung
Durch Umsetzung von Pivaldehyd mit enantiomerenreiner Milchsäure, Mandelsäure oder Prolin wird ein sterisch fixiertes Acetal erhalten, welches Anwendung in der stereoselektiven Synthese findet.[3] Die α-Hydroxycarbonsäuren (S)-Milchsäure (R = CH3) bzw. (S)-Mandelsäure (R = C6H5 = Ph) reagieren diastereoselektiv wie folgt:
Einzelnachweise
- ↑ a b c d e f g Datenblatt Trimethylacetaldehyde bei Sigma-Aldrich, abgerufen am 1. Dezember 2012 (PDF).
- ↑ a b Eintrag zu Pivalaldehyd bei TCI Europe, abgerufen am 2. Dezember 2012.
- ↑ Dieter Seebach, Reto Naef: Enantioselective Generation and Diastereoselective Reactions of Chiral Enolates Derived from α-Heterosubstituted Carboxylic Acids, Helvetica Chimica Acta, 1981, 64, S. 2704–2708 (doi:10.1002/hlca.19810640829).


