Bor(I)-oxid
In der heutigen Welt hat Bor(I)-oxid, sei es als Diskussionsthema, als relevanter Charakter oder als symbolisches Datum, in verschiedenen Bereichen erhebliche Bedeutung erlangt. Ob in der Politik, Kultur, Wissenschaft oder im Alltag, Bor(I)-oxid hat sich als zentrales Element positioniert, das den Ton für unser Handeln und unsere Entscheidungen angibt. In diesem Artikel analysieren wir die Auswirkungen und Relevanz von Bor(I)-oxid in verschiedenen Kontexten sowie seinen Einfluss auf unsere Gesellschaft. Seit seinem Erscheinen hat Bor(I)-oxid großes Interesse geweckt und seine Präsenz löst auch heute noch Debatten und Überlegungen aus.
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
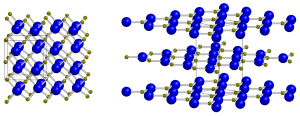
| ||||||||||
| Allgemeines | ||||||||||
| Name | Bor(I)-oxid | |||||||||
| Andere Namen |
Bormonoxid | |||||||||
| Verhältnisformel | B2O | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 37,62 g·mol−1 | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Bor(I)-oxid ist eine chemische Verbindung aus Bor und Sauerstoff. Zwei experimentelle Studien haben die Existenz von diamantartigem[2] und graphitartigem[3] Bor(I)-oxid vorgeschlagen, wie bei Bornitrid und Kohlenstoff-Festkörpern. Eine spätere, systematische, experimentelle Studie zum Phasendiagramm von Bor(I)-oxid legt jedoch nahe, dass dieser Stoff sehr instabil ist.[4] Die Instabilität der graphitartigen B2O-Phase wurde auch theoretisch vorhergesagt.[5]
Einzelnachweise
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ T. Endo, T. Sato, M. Shimada: High-pressure synthesis of B2O with diamond-like structure. In: Journal of Materials Science Letters. Band 6, 1987, S. 683–685, doi:10.1007/BF01770925 (semanticscholar.org [abgerufen am 20. März 2021]).
- ↑ H. Tracy Hall, Lane A. Compton: Group IV Analogs and High Pressure, High Temperature Synthesis of B2O. In: Inorganic Chemistry. Band 4, Nr. 8, 1. August 1965, S. 1213–1216, doi:10.1021/ic50030a027.
- ↑ Vladimir L. Solozhenko, Oleksandr O. Kurakevych, Vladimir Z. Turkevich, Dmitry V. Turkevich: Phase diagram of the B-B2O3 system at 5 GPa: experimental and theoretical studies. In: The Journal of Physical Chemistry. B. Band 112, Nr. 21, 29. Mai 2008, S. 6683–6687, doi:10.1021/jp800625s, PMID 18457447.
- ↑ Matthew P. Grumbach, Otto F. Sankey, Paul F. McMillan: Properties of B2O: An unsymmetrical analog of carbon. In: Physical Review. B, Condensed Matter. Band 52, Nr. 22, 1. Dezember 1995, S. 15807–15811, doi:10.1103/physrevb.52.15807, PMID 9980955.