Xenonsäure
Heutzutage ist Xenonsäure ein Thema, das die Aufmerksamkeit und das Interesse vieler Menschen auf der ganzen Welt geweckt hat. Von der Antike bis zur Neuzeit hat Xenonsäure eine bedeutende Rolle in Geschichte, Kultur und Gesellschaft gespielt. Während sich die Gesellschaft weiterentwickelt, bleibt Xenonsäure relevant und löst weiterhin Debatten und Diskussionen in verschiedenen Bereichen aus. In diesem Artikel werden wir die Bedeutung und Auswirkung von Xenonsäure sowie seinen Einfluss auf verschiedene Bereiche des täglichen Lebens untersuchen.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
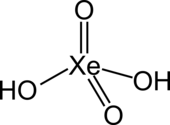
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Xenonsäure | ||||||||||||
| Summenformel | H2XeO4 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 197,31 g·mol−1 | ||||||||||||
| pKS-Wert |
10,5[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Xenonsäure ist eine Säure des Edelgases Xenon. Ihre Salze sind die Xenate XeO42− und die Hydrogenxenate HXeO4−. Ihre Existenz wurde von Linus Pauling vorhergesagt.[3]
Gewinnung und Darstellung
Xenonsäure kann durch Hydrolyse von Xenon(VI)-oxid XeO3 hergestellt werden, wobei nur ein kleiner Teil zur Säure reagiert.[1]
Eigenschaften
Xenonsäure ist ein starkes Oxidationsmittel. In saurer Lösung ist es in der Lage, Iod schnell zu oxidieren.[4] Die wässrige Lösung ist nur schwach sauer.[1] In freier Form ist sie nicht bekannt.[5]
Durch Zugabe einer Base zu Xenon(VI)-oxid bildet sich das Hydrogenxenat-Ion HXeO4−:
Die Disproportionierung des Hydrogenxenat-Ion lässt das Perxenat-Ion XeO64− entstehen.[1][6]
Einzelnachweise
- ↑ a b c d A. F. Holleman, Egon Wiberg, Nils Wiberg: Inorganic Chemistry. Hrsg.: Nils Wiberg. Academic Press, 2001, ISBN 0-12-352651-5, S. 399.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Linus Pauling: The Formulas of Antimonic acid and the Antimonates. J. Am. Chem. Soc., 1933, S. 1895–1900, doi:10.1021/ja01332a016.
- ↑ Howard H. Claassen: The Noble Gases. Heath, 1966, S. 65.
- ↑ Peter Paetzold: Chemie: Eine Einführung. Walter de Gruyter, 2009, ISBN 978-3-11-021135-1, S. 695 (books.google.com).
- ↑ David W. Oxtoby, Wade A. Freeman, Toby F. Block: Chemistry 4th Edition. ISBN 0-03-033188-9, Kap. 4, S. 87AP.




